La capacité de production de l'eau pour l'injection avec la pleine méthode de membrane est 500-30000L/H, qui est utilisée dans les industries médicales, chimiques quotidiennes et autres. Il utilise la technologie d'ultrafiltration finale pour éliminer les impuretés de la source de chaleur sur la base de l'eau purifiée traditionnelle, de sorte que l'indice d'endotoxine est inférieur aux exigences standard de la pharmacopée, fournissant un nouveau, choix stable et fiable pour la préparation deEau pour système d'injectionPour les entreprises concernées.
Bactéries | ≤ 50 CFU/100ml |
Endotoxine bactérienne | ≤ 0.25 UE/ml |
Conductivité (résistivité) | ≥ 10.0 Maman/cm (≤ 0.1 μS/cm) |
Carbone organique total | ≤ 500 ppb |
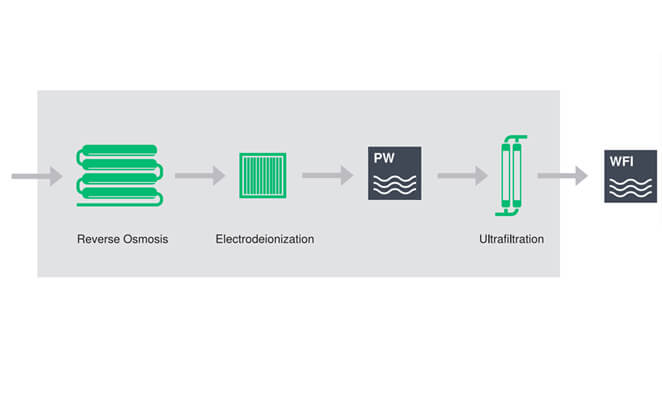
LeSystème de RO usine de traitement de l'eau, Combiné avec le module EDI et le module d'ultrafiltration, fournit une méthode de production robuste d'eau pour injection pour produire un WFI froid qui répond aux normes de qualité de la pharmacopée:
Le poids moléculaire de l'élément de membrane d'osmose inverse est 100 Dalton, qui peut éliminer les pyrogènes et les micro-organismes.
L'empilement de membrane EDI peut éliminer profondément les substances ionisables qui peuvent réduire la conductivité de l'eau grâce à la combinaison de membrane échangeuse d'ions, de résine échangeuse d'ions et de potentiel DC.
Le poids moléculaire du module d'ultrafiltration est 6000 daltons, qui est utilisé pour réduire l'endotoxine, la TOC et les bactéries.
Tous ces composants peuvent résister à la désinfection de l'eau chaude pour prévenir et contrôler la formation de biofilm.
Une efficacité énergétique plus élevée.
Conception modulaire pour répondre aux exigences spécifiques au client.
Système dérapé, compact.
Facile d'entretien.
Répond à tous les compendiaux applicables (USP, EP, JP).
Répond à toutes les directives de fabrication pharmaceutique réglementaires (GMP,FDA).
Téléphone:
Courriel:
Adresse:
Room 1904, Building 10, No. 218, Jiqingmen Street, Jianye District, Nanjing, Jiangsu, China